检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
2021年1月8日,新葡萄8883官网AMG邓宏魁课题组和李程课题组在《Cell Research》上发表了题为“Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration”的研究论文,在体外构建了具有损伤再生特征的新型小肠类器官。类器官(organoid)是由干细胞衍生出来的类似器官的组织,被认为是构建人工器官或开发新药的下一代技术。基于这一新型类器官模型,邓宏魁研究组开发了一组表观遗传调控的化学小分子,能够在小鼠体内促进肠道上皮组织的损伤修复。这项工作为研究器官再生提供了新的体外模型,同时也揭示了基于化学小分子的表观遗传调控在器官再生中的重要作用。
类器官能够在体外模拟体内器官的三维结构和功能,已被广泛应用于功能组织诱导、疾病模型建立、药物筛选等方面的研究,成为过去十年再生医学领域最重要的突破之一。但是目前的类器官制备技术存在明显缺陷:尽管模拟了体内稳态环境下干细胞及其分化细胞的相互作用,但无法呈现器官组织损伤再生状态下的变化。在体内损伤诱导的再生过程中,会出现损伤态干细胞来主导组织损伤修复的过程。如何在体外建立能够捕获损伤态干细胞的类器官培养方法,是类器官研究及应用面临的重要挑战。
为了解决这一问题,邓宏魁研究组以类器官研究中广泛使用的小肠类器官为模型,进行功能筛选,建立了一个新的培养条件(简称8C),诱导小肠类器官表达损伤再生相关基因,并且生长出更加复杂的三维结构。这些特征与肠道损伤再生过程出现的“增生态”隐窝非常相似(隐窝位于绒毛基部,是由干细胞及其后代组成的增殖区域),为此称之为“增生态”小肠类器官,简称Hyper类器官。与传统类器官相比,Hyper类器官的扩增能力得到了极大增强:连续培养5代之后,小肠干细胞数量相比传统类器官提升了约10000倍。此外,Hyper类器官能够长期传代扩增并保持基因组的稳定性。
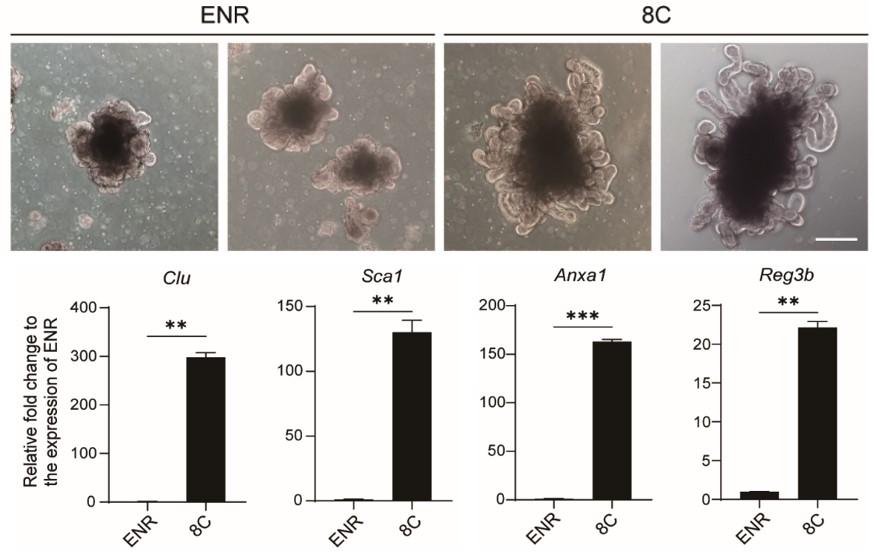
传统ENR条件和8C条件诱导的小肠类器官形态(上图)及关键损伤再生基因表达(下图)
作者通过单细胞转录组测序技术对Hyper类器官中的细胞群体进行解析,发现Hyper类器官中显著富集了肠道干细胞群和修复型干细胞群,这些干细胞群体与体内发现的肠道损伤态干细胞具有相似的分子特征。通过谱系追踪和单细胞重建类器官实验,证实了Hyper类器官中的细胞具有肠道干细胞的功能。进一步分析发现8C培养条件中的两个表观遗传调控小分子VPA和EPZ6438,通过激活YAP通路下游基因,对类器官获得再生特征发挥了关键的调控作用。作者进一步研究了表观遗传调控小分子VPA和EPZ6438的联合处理对体内肠道组织损伤修复的作用。研究发现在辐照诱导的小肠损伤小鼠模型中,小分子联合处理能够提升YAP下游靶基因的表达水平,增强小肠隐窝组织的再生能力。除了小肠体系,该组合也能促进结肠组织的损伤修复,减轻急性结肠炎动物模型的病理学症状。
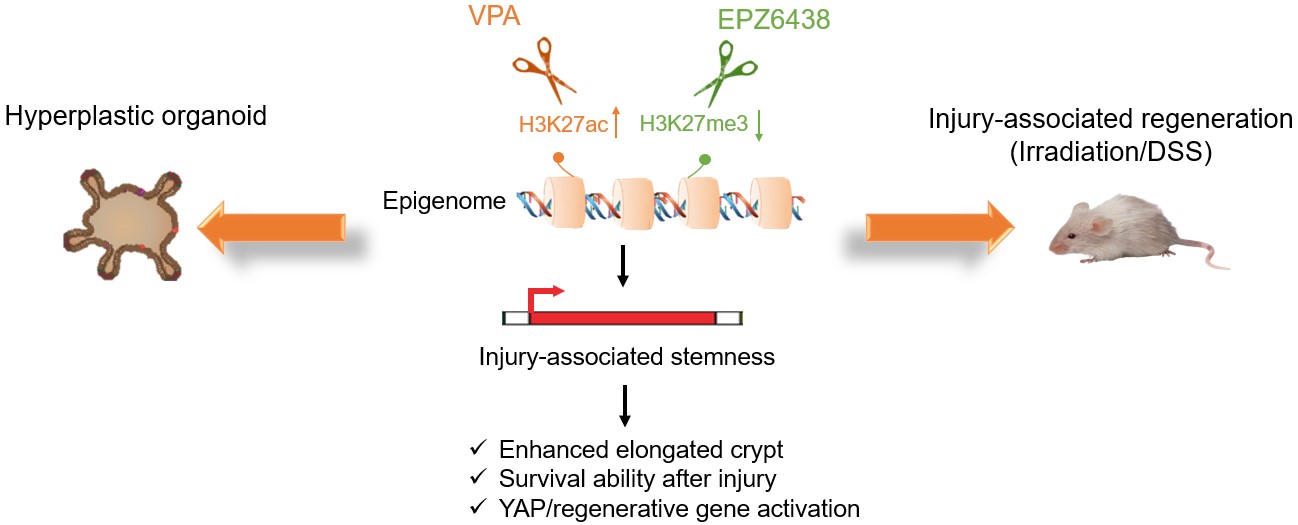
化学小分子介导的表观重编程促进小肠类器官的再生修复
该研究在体外建立了新型类器官模型,解决了类器官技术在体外无法模拟损伤再生条件下器官和组织变化的难题。该模型能够捕获并维持器官再生中的损伤态干细胞亚群,同时具备在体外高效扩增和长期维持的能力,为利用类器官技术研究器官再生、建立疾病损伤模型和药物筛选提供了新的途径。
邓宏魁研究组长期致力于化学小分子调控细胞命运的研究和应用,近年来取得了一系列突破:诱导体细胞重编程为多潜能干细胞;诱导皮肤成纤维细胞为功能神经元细胞;建立了具备全能性功能特征的多潜能干细胞;利用化学小分子实现了体外肝细胞功能的长期维持。本项研究进一步显示了化学小分子在调控器官再生功能方面的关键作用,这一方法可望广泛应用于其他组织类型的类器官培养。
北京大学邓宏魁教授、北京大学干细胞研究中心徐君研究员及北京大学李程研究员为该论文的共同通讯作者,屈默龙博士、熊亮博士、博士研究生吕钰麟为该论文的共同第一作者。本工作获得了生命科学联合中心、国家重点研发计划、国家自然科学基金等基金的资助。