检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
2019年6月28日,新葡萄8883官网AMG、北大清华联合中心李龙课题组与高宁课题组合作在 《Nature Communications》 杂志上在线发表了题为“Structure of the substrate-engaged SecA-SecY protein translocation machine”的研究论文。
蛋白转运是生物生命活动中一种必不可少的过程,可以将分泌型蛋白从细胞内输出并将膜蛋白整合到脂质双分子层中。转运的核心组分是进化上保守的蛋白转运通道,在真核生物中为Sec61通道,在原核生物中为SecY通道。Sec61 / SecY通道可以使多种蛋白在真核生物内质网膜或原核生物的质膜上进行转运。在细菌中,大多数分泌型蛋白通过SecA ATPase的介导,穿过SecY通道实现翻译后转运。但是由于缺乏结构信息,人们对多肽如何通过SecA-SecY复合物的理解知之甚少。此文章解析了脂质环境下SecA-SecY复合物中间态的电子冷冻显微镜(cryo-EM)结构,首次揭示了多肽底物与SecA-SecY在转运过程中的相互作用。
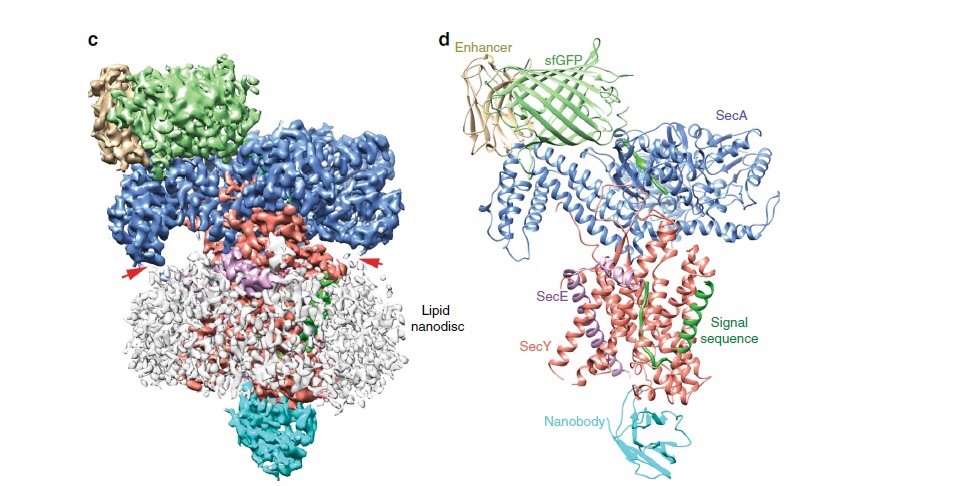
SecA-SecY-底物总体结构
在该结构中,多肽底物N端的信号肽被SecY通道和脂分子共同识别;C端肽段穿过SecY中央孔道, 经过SecA的two-helix finger结构,在SecA入口处,被SecA的一个像夹子样的结构卡住,形成β片层结构。结合之前的生理和生化数据,该结构在分子水平上提供了SecA在ATP水解循环对众多底物的序列非特异识别机制,为全面理解ATP驱动的多肽转运过程奠定了坚实的基础。
新葡萄8883官网AMG、北大清华生命科学联合中心李龙研究员、高宁教授与美国哈佛医学院Tom Rapoport教授为该论文的共同通讯作者。新葡萄8883官网AMG高宁组博士后马成英以及李龙组技术员吴晓飞为该论文的共同第一作者。该项研究得到了膜生物学国家重点实验室、北大清华生命科学联合中心、科技部重点研发计划以及国家自然科学基金的经费支持,冷冻电镜数据采集得到了北京大学电子显微镜实验室及北大冷冻电镜平台的支持,负染电镜分析得到了新葡萄8883官网AMG仪器中心的支持,结构计算得到了北京大学计算中心高性能平台的支持。