检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
2019年5月15日,Molecular Cell杂志在线发表了题为Conformational Complexity and Dynamics in a Muscarinic Receptor Revealed by NMR Spectroscopy的研究论文,报道了应用液体核磁共振方法研究M2毒蕈碱型乙酰胆碱受体结构动态性的工作,并结合功能实验和分子动力学模拟,揭示了GPCR 信号转导多样性的分子机制。
G蛋白偶联受体(GPCR)家族是最大的一类膜蛋白家族受体,在视觉,嗅觉,味觉,以及激素和神经递质等信号转导中发挥着重要的生理功能,同时也是关键的药物靶标。近年来,随着越来越多GPCR在失活和激活状态下的晶体及电镜结构的解析,人们对于这一大类受体的激活机制有了愈发深入的了解。然而,GPCR受体的失活和激活结构仅代表了信号转导过程起始和终止时相对稳定的构象状态,受体在激活过程中发生了复杂多样的动态构象变化,这些变化很可能与不同配体引起的信号转导多样性相关。目前,GPCR在激活过程中的动态构象变化仍不清楚,国际上这方面的研究尚处于起步阶段。液体核磁共振方法能够在原子分辨率水平研究蛋白质相互作用和构象变化,提供晶体或电镜结构缺失的信息,是GPCR动态结构与激活机制研究中不可缺少的重要研究手段。
M2毒蕈碱型乙酰胆碱受体(M2R)是一个典型的GPCR,在调节人体心率和许多中枢神经系统功能中发挥重要作用,是研究GPCR 信号转导、调节以及药物设计的模式受体。本篇文章通过在M2R中引入13CH3-ε-甲硫氨酸同位素标记探针,检测受体在结合一系列配体小分子时的核磁图谱变化(图一),分析M2R动态构象变化与这些配体对G蛋白激活和抑制蛋白 (arrestin)募集效应差异的相关性。同时,结合分子动力学模拟实验进一步解释不同配体结合导致受体激活时构象和功能变化差异的分子机制。该项研究首次将M2R的配体结构、受体构象变化以及配体功能多样性联系起来,揭示了M2R信号转导多样性可能的分子机制,并为针对这类重要受体的药物研发提供了理论指导。
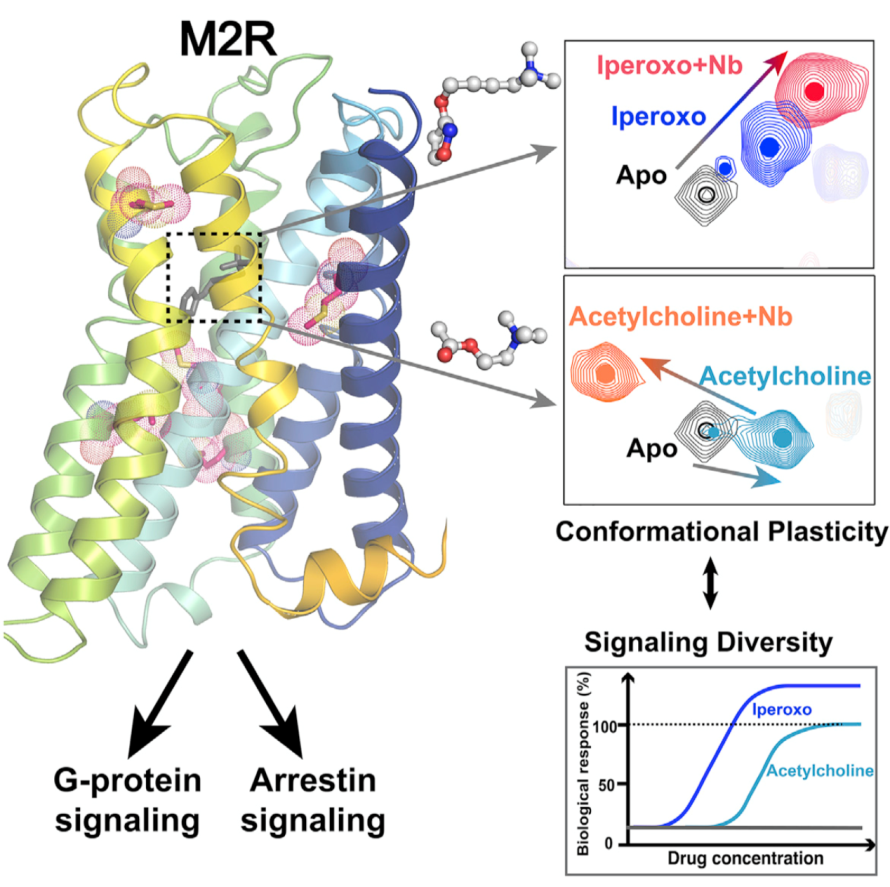
图一:内源配体乙酰胆碱(acetylcholine)与晶体结构解析的配体iperoxo具有不同功效,在结合受体时呈现差异性的化学位移指纹图谱,揭示受体激活时发生不同的构象变化。
北京大学金长文教授与清华大学Brian K. Kobilka教授为本文的共同通讯作者。清华大学医学院博士生徐俊为本文的第一作者。原北京大学核磁共振中心副研究员胡蕴菲博士(现为苏州大学医学部教授)参与了核磁实验以及数据的处理和分析。北京大学核磁共振中心牛晓刚博士和李红卫博士协助完成核磁数据的收集。德国弗里德里希-亚历山大 埃尔朗根-纽伦堡大学化学与药理学系Peter Gmeiner课题组负责了本研究的功能实验和分子动力学模拟实验。斯坦福大学医学院助理研究员Shoji Maeda为本研究的功能实验提供了帮助。本文的核磁数据全部在北京大学核磁共振中心和凤凰工程核磁平台收集完成。
金长文课题组长期致力于用液体核磁共振技术表征生物大分子的结构与动态构象变化。本篇文章是北京大学金长文课题组与清华大学Brian K. Kobilka课题组在GPCR动态结构合作研究中的一项阶段性成果,展现了核磁共振技术在膜蛋白受体动态研究中的重要应用。目前正在进行更深入的动态结构研究,将有助于进一步加深人们对GPCR信号转导多样性的分子机制的理解。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30320-X