检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
代谢功能障碍相关脂肪性肝病(Metabolic dysfunction-associated steatotic liver disease,MASLD)是目前最常见的慢性肝病之一,影响了全球约三分之一的人口。该疾病谱广泛,涵盖了从单纯脂肪变性到代谢功能障碍相关脂肪性肝炎(Metabolic dysfunction-associated steatohepatitis,MASH)等多种病变。如果不及时干预,MASLD可能进一步进展为肝硬化、肝功能衰竭,甚至肝癌。然而,迄今为止针对MASLD的有效治疗手段仍然十分有限。
2024年8月24日,新葡萄8883官网AMG朱健/刘敏课题组在Journal of Lipid Research期刊上在线发表了题为Therapeutic siRNA targeting PLIN2 ameliorates steatosis, inflammation, and fibrosis in steatotic liver disease models的封面论文,确认了脂滴表面蛋白PLIN2是一个有前景的MASLD治疗靶点。研究团队开发了针对PLIN2的GalNAc-siRNA偶联药物,并在多种MASLD/MASH小鼠模型中验证了其显著疗效及良好的生物安全性。研究还揭示了该siRNA药物通过促进VLDL分泌发挥治疗作用的机制,并进一步利用人源化小鼠模型证明了其作为临床候选药物的潜力。这项研究为MASLD/MASH的治疗提供了一种新的可能性,提出了针对不同致病机制的患者群体的潜在治疗策略。
研究者的前期工作表明,Plin2蛋白是维持脂滴稳态的关键因子[1, 2]。基于这一发现,研究者首先设计了针对Plin2的siRNA以抑制其表达,并通过多种化学修饰增强siRNA药物的稳定性和延长其半衰期,同时优化其肝脏递送效率。随后,研究者在高脂饲料诱导的肥胖模型和ob/ob小鼠等多个MASLD模型中验证了siRNA药物的体内疗效,结果显示该siRNA药物在缓解肝脏脂肪变性、减轻肝脏损伤以及改善代谢能力方面均表现出良好的治疗效果(图1)。
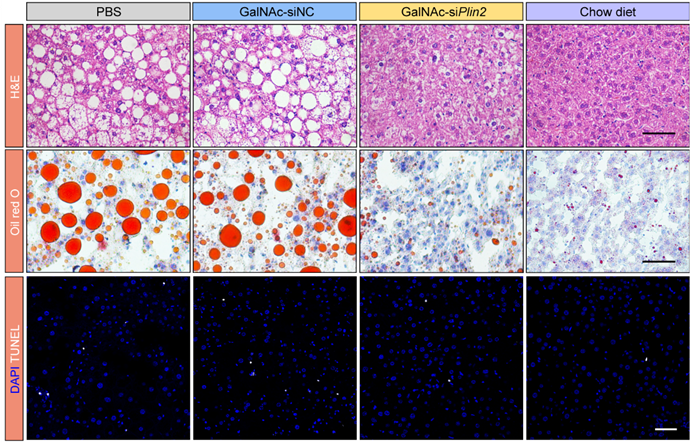
图1 GalNAc-siPlin2对高脂饲料诱导的MASLD小鼠模型的治疗效果
接下来,研究者探讨了该疗法的作用机制。在检测了多种影响肝脏脂肪代谢的因子后,发现该siRNA药物可能通过促进肝脏极低密度脂蛋白-甘油三酯(VLDL-TG)的分泌来发挥作用,并加速机体对分泌脂肪的代谢和产热过程(图2)。
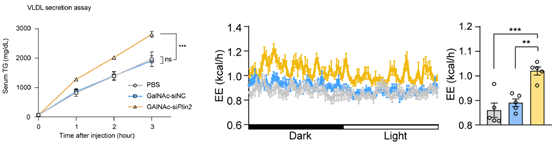
图2 GalNAc-siPlin2治疗增加肝脏VLDL-TG分泌并促进代谢产热
为了探究该疗法对MASLD炎症和纤维化进程的影响,研究者采用高脂高果糖饮食诱导的小鼠模型,并检验了该siRNA药物的治疗效果。数据显示,在野生型小鼠和人源化PLIN2敲入小鼠中,该核酸药物均能有效缓解脂肪变性、炎症和纤维化等多项指标,进一步证实了其作为MASLD治疗药物的潜力(图3)。
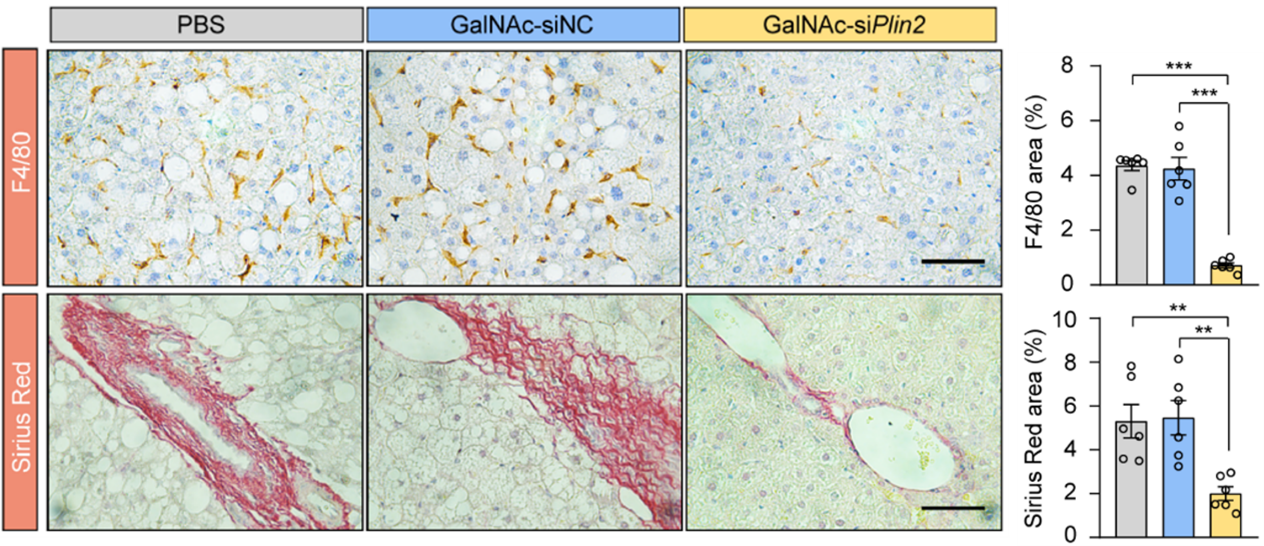
图3 GalNAc-siPlin2治疗改善高脂高果糖饮食诱导的MASH小鼠的炎症和纤维化
新葡萄8883官网AMG朱健教授、刘敏副研究员、已出站博雅博士后张延松博士是该论文的共同通讯作者,新葡萄8883官网AMG博士研究生王尧是该论文的第一作者,新葡萄8883官网AMG本科生周佳欣对本研究有重要贡献,北京大学邱义福课题组为该研究提供了技术支持,北京大学雷晓光教授、陈晓伟教授为该研究提供了建议和帮助,新葡萄8883官网AMG公共仪器中心和凤凰工程蛋白质平台提供了技术支持。本研究得到国家自然科学基金、国家重点研发计划、北京大学成都前沿交叉生物技术研究院、北大-清华生命科学联合中心、细胞增殖与分化教育部重点实验室以及中国博士后科学基金的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S0022227524001408
参考文献:
[1] Zhang, Y.*, Lin, S.*, Peng, J.*, Liang, X., Yang, Q., Bai, X., Li, Y., Li, J., Dong, W., Wang, Y., Huang, Y., Pei, Y., Guo, J., Zhao, W., Zhang, Z., Liu, M.# and Zhu, A. J.# (2022) Amelioration of hepatic steatosis by dietary essential amino acid-induced ubiquitination.Molecular Cell82: 1528-1542. doi: 10.1016/j.molcel.2022.01.021
[2] Zhao, W.*, Zhang, Y.*#, Lin, S., Li., Y., Zhu, A. J., Shi, H.# and Liu, M.# (2023) Identification of Ubr1 as an amino acid sensor of steatosis in liver and muscle.Journal of Cachexia, Sarcopenia and Muscle14: 1454–1467. doi: 10.1002/jcsm.13233