检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
表观遗传信息的继承 (Epigenetic inheritance)是细胞增殖和分化的核心基础,理解这一过程对我们认识正常发育和衰老等生理过程和解析发育异常、肿瘤和早衰等病理过程都至关重要。作为真核生物特有的遗传机制,在遗传物质DNA序列不变的前提下,表观遗传信息的继承,是细胞身份记忆的核心基础,而表观遗传信息继承的弹性,也为重塑细胞身份提供独特的窗口。染色质是编码表观遗传信息的主要载体,其基本结构单元是核小体,由一段147 bp DNA缠绕组蛋白八聚体构成。组蛋白携带不同的翻译后修饰,蕴藏丰富的表观遗传信息,和其它因子一起形成染色质景观,决定了基因组的表达谱,形成细胞的身份。弹性的表观遗传信息继承是染色质景观的维持和重塑的基础,其核心步骤是DNA复制偶联的染色质重建,最重要的一环是DNA复制叉上亲本组蛋白的回收和再分配。
李晴研究组围绕DNA复制偶联的核小体组装,聚焦在亲本组蛋白在复制叉上的回收和分配机制。2023年在《核酸研究》杂志上发表“The N-terminus of Spt16 anchors FACT to MCM2-7 for parental histone recycling” 研究论文,揭示组蛋白分子伴侣FACT直接参与复制叉位点亲本组蛋白的原位回收,并且同时贡献于两条子链;通过和复制体元件相互作用,组成“组蛋白分子伴侣-组蛋白-复制体元件”通用模块,调节亲本组蛋白流向。2024年,和合作者(翟元梁/高宁/戴碧瓘团队)在《自然》杂志发表“Parental histone transfer caught at the replication fork”研究论文,捕获首个内源复制叉上亲代组蛋白递送的起始态,发现组蛋白分子伴侣FACT和复制体保护复合物(Tof1-Csm3)以及解旋酶亚基Mcm2一起捕获亲本组蛋白六聚体【(H3-H4)2-(H2A-H2B)】往滞后链递送的机制。这些工作较为全面的理解复制体元件调节亲本组蛋白回收和递送途径,然而,亲本组蛋白在两条子链的分配机制仍不明了。

2024年8月1日,北京大学李晴研究组和哈佛医学院、霍华德休斯医学研究院(HHMI) Danesh Moazed研究组合作在《细胞》杂志发表了题为“A replisome-associated histone H3-H4 tetramer chaperone required for epigenetic inheritance”的研究论文。在本研究中,作者通过遗传筛选、生化、分子生物学和生物物理学等方法,结合AlphaFold-Multimer结构预测等手段发现DNA复制体(replisome)中复制叉保护复合物亚基Mrc1/CLASPIN(另外两个亚基是Tof1和Csm3)存在一段在真核生物中保守的组蛋白H3-H4四聚体结合区域。
本研究首先通过异染色质沉默报告体系确认了裂殖酵母中Mrc1与FACT在异染色质沉默中的关键作用,随后通过IP-MS手段确认了Mrc1的C端负责其与FACT以及其他复制体元件的相互作用。AlphaFold-Multimer结构预测表明,Mrc1具有一段保守的Mrc1-like domain(Mrc1-MLD),很可能与组蛋白H3.1-H4四聚体存在互作(图1)。其中的α1-3三个螺旋较为对称地箍住H3.1-H4四聚体:α1与α3各结合一个H3-H4二聚体,而α2同时结合两个H4。综合已有的核小体核心颗粒的晶体结构,Mrc1-MLD很可能通过模拟核小体的特性从而部分取代核小体DNA及H2A-H2B二聚体进而结合H3-H4四聚体。体外pull-down实验进一步表明,Mrc1-MLD能够特异地结合组蛋白H3-H4,这一点在酿酒酵母Mrc1以及人源CLASPIN也都得到证实。裂殖酵母和芽殖酵母中的实验也都证明Mrc1-MLD参与维持异染色质沉默。
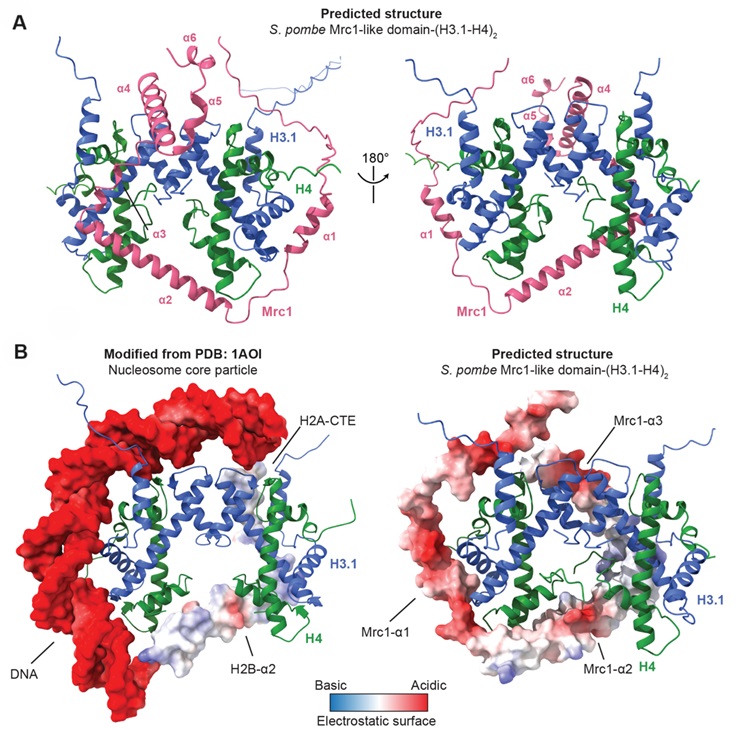
图1 AlphaFold-Multimer预测一段演化保守的Mrc1/CLASPIN区域结合组蛋白H3-H4四聚体
作者之后通过eSPAN(enrichment and sequencing of protein-associated nascent DNA)方法分析Mrc1与H3-H4的相互作用在亲本组蛋白回收和递送中的作用。作者首先在芽殖酵母中发现,Mrc1全敲除或大片段敲除MLD区段会导致亲本组蛋白往前导链递送缺陷。进一步在芽殖酵母和裂殖酵母中进行小片段筛选和定点突变分析,发现Mrc1结合组蛋白区域同时影响前导链和滞后链的亲本组蛋白递送。据此,作者得出结论:Mrc1是一个在DNA复制体上的组蛋白分选组分(图2)。
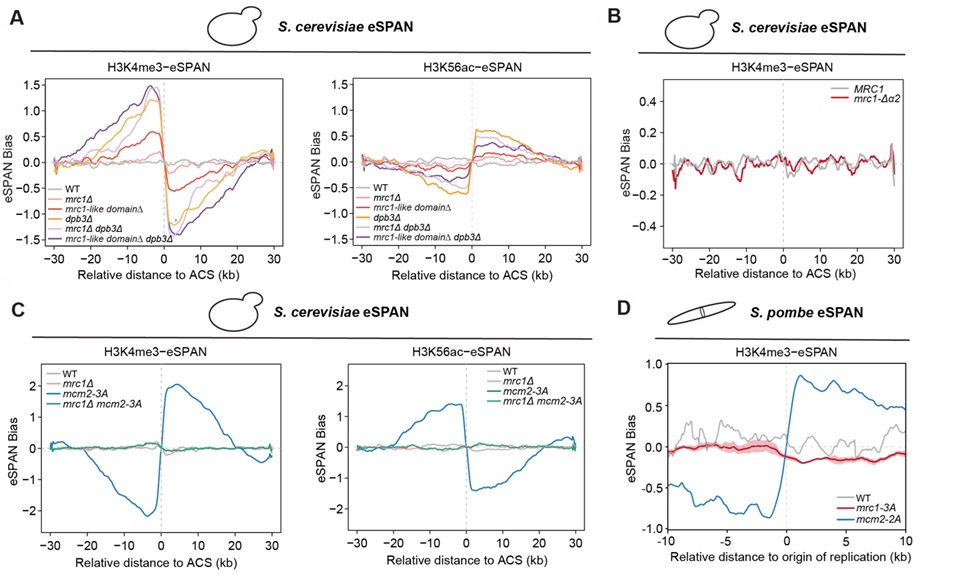
图2 eSPAN分析Mrc1-MLD调节亲本组蛋白回收
综上所述,本工作发现Mrc1/CLASPIN能够结合H3-H4四聚体,这对复制偶联的亲本组蛋白回收十分重要。Mrc1与FACT以及其他复制体元件共同调节亲本组蛋白在两条子链上的分配(图3)。本工作在已有研究的基础上进一步丰富了复制叉处亲本组蛋白的回收机制,加深了对于复制偶联的表观信息遗传的理解。长期以来领域内对于亲本组蛋白回收过程的认识都较为碎片化,而近期的李晴实验室的几篇工作(Nucleic Acids Research,2023;Nature,2024;Cell,2024) 给出了复制叉上的关键蛋白在亲本组蛋白回收中的作用机制,拓展了对复制叉保护复合物(Mrc1-Tof1-Csm3)功能的认识。Mrc1能够结合组蛋白H3-H4,从而直接参与亲本组蛋白的回收和分配;Tof1则依托其在复制叉前端的位置以及与FACT、Mcm2和Mrc1的相互作用,调控亲本组蛋白的流向。综合领域内前期研究,Mcm2与Pol1的组蛋白结合区域倾向于将亲本组蛋白遗传到滞后链,而Dpb3-Dpb4倾向于将组蛋白遗传到先导链。至此,亲本组蛋白的解离、递送和重组装过程得到了较为充分的阐释,复制体元件对亲本组蛋白回收框架的支撑得到了较为全面的理解。
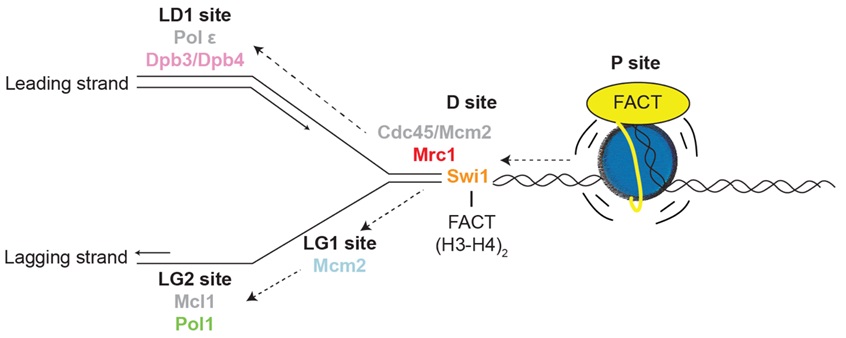
图3 DNA复制叉上的亲本组蛋白递送模型图
哈佛大学博士生俞钧陶、北京大学博士生张煜婕为该论文并列第一作者,哈佛医学院、霍华德休斯医学研究院(HHMI)教授Danesh Moazed和北京大学教授李晴为共同通讯作者,哥伦比亚大学贾松涛(Songtao Jia)研究组,哥伦比亚大学医学院张志国(Zhiguo Zhang)研究组以及哈佛医学院Steven Gygi研究组也参与了本研究。李晴研究组感谢国家自然科学基金委员会、北京市教育委员会、北京大学-清华大学生命科学联合中心和蛋白质与植物基因研究国家重点实验室的资助。
原文链接:https://doi.org/10.1016/j.cell.2024.07.006