检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
2023年1月4 日,新葡萄8883官网AMG李龙组与前沿交叉学科研究院定量生物学中心宋晨组合作,在PNAS期刊发表题为Structural basis of SecA-mediated protein translocation的研究论文。该研究发现SecA ATPase推动的蛋白转运与解旋酶推动的核酸转运在分子水平上有高度的相似性。
蛋白质跨膜转运是生物生命活动中一种必不可少的过程。蛋白质通过定向转运,从细胞质运输到细胞外。细菌中最重要的蛋白质跨膜转运系统是Sec系统,绝大多数分泌型蛋白质被高度保守的SecA ATP水解酶识别并推动,经过SecY通道穿越细胞膜。经过三十多年的研究,人们对Sec系统介导的蛋白质跨膜转运过程有了较为全面的了解,但是对SecA通过ATP水解驱动蛋白穿膜的分子机理仍然存在很大争议。研究瓶颈主要在于缺乏不同核苷酸结合状态下的活性SecA-SecY复合物的结构,特别是在ADP状态下的结构。此前仅有ATP类似物结合状态下的SecA-SecY复合物的结构 [1]。ADP结合状态下的SecA-SecY复合物非常不稳定,多年来领域内广泛认为难以解析其结构。
李龙组经过几年的探索,最终通过二硫键交联和纳米脂盘等多种技术在体外稳定SecA-SecY-蛋白底物复合物与ADP结合的状态,利用单颗粒冷冻电镜(cryo-EM)技术获得其高分辨结构。通过与ATP类似物结合的结构比较,发现蛋白底物在SecA-SecY复合物中可以被ATP水解驱动。这是人们第一次直接观察到ATP水解过程中SecA,SecY,和蛋白底物在不同中间状态下的构象。
结构分析显示,在结合ATP后,SecA的核苷酸结合结构域由开放状态转变为关闭状态,该构象变化传递至SecA的“夹子”结构单元,推动蛋白底物移向SecY通道。生化突变研究验证了SecA的“夹子”在蛋白质转运中的重要性。之后,分子动力学模拟确认SecA“夹子”两侧与蛋白底物的相互作用在ATP水解过程中发生强度交替变化,从而产生使蛋白底物穿膜的单一方向驱动力。这一分子过程与核酸解旋酶的“蠕虫运动”模型有高度的相似之处 (图1)。
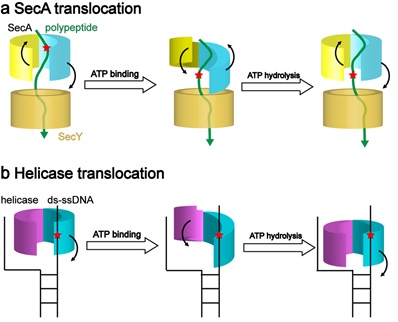
图1:SecA和DNA解旋酶的转运机理比较
本研究揭示了SecA在ATP水解循环中推动蛋白底物通过SecY通道的分子机制,解决了领域内长期存在的争论,发现了蛋白质和核酸转运之间的相似性,为开发新型抗生素提供了新的潜在作用靶点。
新葡萄8883官网AMG李龙研究员和北京大学定量生物学中心宋晨研究员为通讯作者。17级新葡萄8883官网AMG博士生董林琳为第一作者。北大-清华生命科学联合中心19级博士生杨嵩为第二作者,负责了分子动力学模拟工作。新葡萄8883官网AMG19级博士生陈静霞、22级博士生吴晓飞和前实验员孙东杰也参与了这一工作。高宁教授和李宁宁副研究员对本研究的结构计算部分提供了重要指导。该工作得到了北京大学冷冻电镜平台、高性能计算中心、生科院仪器中心、膜生物学国家重点实验室、以及北大-清华生命科学联合中心的大力支持。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2208070120
标注:
[1] 北大生科. Nature Communications | 李龙研究组和高宁研究组合作解析SecA-SecY蛋白转运机制的底物嵌合结构. http:/homes/Index/news_cont/22/14629.html,2019-07-02.