检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 老版新葡萄8883官网 / 学术科研
2020年7月27日及10月9日,新葡萄8883官网AMG高宁研究组与卡耐基梅隆大学的 John L. Woolford Jr. 研究组合作在Nature Communications杂志分别发表题为 “Coupling of 5S RNP rotation with maturation of functional centers during large ribosomal subunit assembly” 和 “Structural insights into assembly of the ribosomal nascent polypeptide exit tunnel” 的研究论文,报道了真核核糖体大亚基在细胞核中的多个高分辨的前体结构,揭示了核糖体大亚基功能中心在细胞核内的组装机制以及它们之间的关联。
真核核糖体的组装是一个极其复杂又高度分级的过程,涉及核糖体 RNA(rRNA)的转录,修饰,加工和折叠以及核糖体蛋白质的结合。在高等真核生物中,有超过300种因子参与核糖体的组装,从而保证核糖体的生成准确而高效地进行。核糖体的组装与细胞的生长、增殖和分化密切相关,研究表明人类细胞中参与核糖体组装过程的蛋白发生突变会导致组织特异性缺陷的人类疾病,统称为核糖体病变(ribosomopathy)。例如先天性再生障碍性贫血症(DBA, Diamond-Blackfan anemia)临床表现为贫血、低网织红细胞计数、巨红细胞以及胎儿血红蛋白表达增加和腺苷脱氨酶活性升高,是由于多种编码核糖体蛋白的基因突变所造成的,包括RPS19、RPL5和RPL11等。此外,当核糖体组装出现错误时,游离的5S RNP(CP 的组成部分)会与肿瘤抑制因子p53的抑制子MDM2结合,并将其隔离在核仁中,导致p53激活,细胞周期停滞并最终导致细胞凋亡。
得益于冷冻电镜技术的发展,以酵母为模式生物,真核核糖体前体的多个不同状态的高分辨结构获得了解析。尽管拥有如此丰富的结构信息,但是领域对于核糖体的重要功能中心的组装以及它们之间在组装时是否存在偶联还知之甚少,此外对于大部分组装因子的具体分子功能尚待探索。核糖体大亚基的功能模块包括中央凸起(CP, central protuberance)、肽基转移酶中心(PTC, peptidyl transferase center)以及新生肽链出口隧道(NPET, nascent polypeptide exit tunnel),这些功能中心在进化上是高度保守的。真核核糖体大亚基的前体从核仁到核质的组装过程中,结构会发生一些列的重大重组,其中包括组成CP的 5S RNP 的旋转、组成PTC的 rRNA螺旋H68-71的构象转换,以及组装因子 Nog1的C端探入并结合NPET。
本研究结合分子遗传学,生物化学以及冷冻电镜技术深入的研究了与CP PTC、NPET 组装相关的组装因子的功能,包括Rpf2、Sda1、Nog1以及核糖体蛋白uL4。通过一个组装因子 Nog2 作为诱饵,在其 C 端加入亲和标签,从 rpf2△255-344突变体、Sda1-depletion 突变体、rpl4Δ63-87突变体以及 nog1Δ595-647 rei1Δ341-393 reh1Δ380-432三突变体中亲和纯化出多个细胞核时期的大亚基前体的内源复合物。进一步通过定量质谱和冷冻电镜表征了这些前体复合物的组成和结构。实验结果表明,早期RNA构象成熟可以作为结构检查点,指导组装进入下一个步骤,例如Rpf2 CTD的缺失会使得rRNA螺旋 H68-70处于不正常的中间状态,从而进一步影响了5S RNP 的旋转以及 PTC 和 NPET 的组装。作者提出 Rpf2-Rrs1 复合体稳定锚定到核糖体大亚基前体,帮助 H68-70 的正确折叠是核糖体大亚基组装过程中的一个关键质量控制检验点。在针对NPET组装相关的Nog1和uL4的突变株研究中,作者发现 NPET 的组装与 5S RNP 的旋转是通过 H74 相互偶联的,H74 接收NPET组装缺陷的信号并阻止CP区域的进一步成熟,并且通道结合蛋白uL4的突变会产生一系列的处于不同组装阶段的缺陷前体(很可能是turnover的中间体),表明NPET的组装是前体核内成熟中的一个重要质量检查点。
本项工作揭示了真核核糖体前体是如何感知 PTC 以及 NPET 的组装缺陷并将其传递给其它区域,以及大亚基功能中心的组装是如何关联并相互影响的,为深入理解核糖体大亚基的组装过程提供了重要的结构线索。
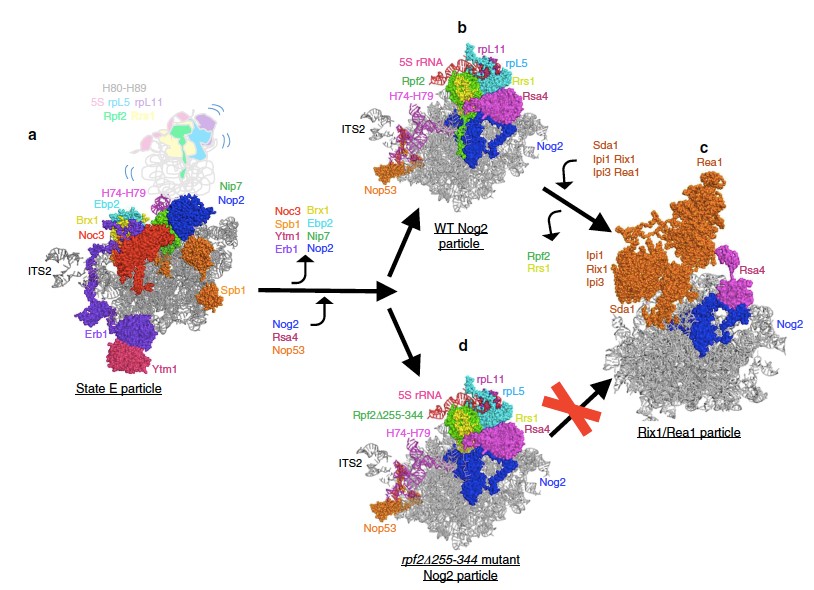
图 一、真核核糖体大亚基功能中心(CP)的组装步骤。
新葡萄8883官网AMG高宁教授和卡耐基梅隆大学的 John L. Woolford Jr.教授为这两篇文章的共同通讯作者,高宁实验室 2015 级博士研究生李余为两篇论文的共同第一作者。该系列课题受到国家自然科学基金委员会、科技部和美国国立卫生研究院的项目资助,以及北京大学冷冻电镜平台、高性能计算中心、生命科学联合中心、生科院仪器中心、膜生物学国家重点实验室的支持。